라울의 법칙[ Raoult's law ]
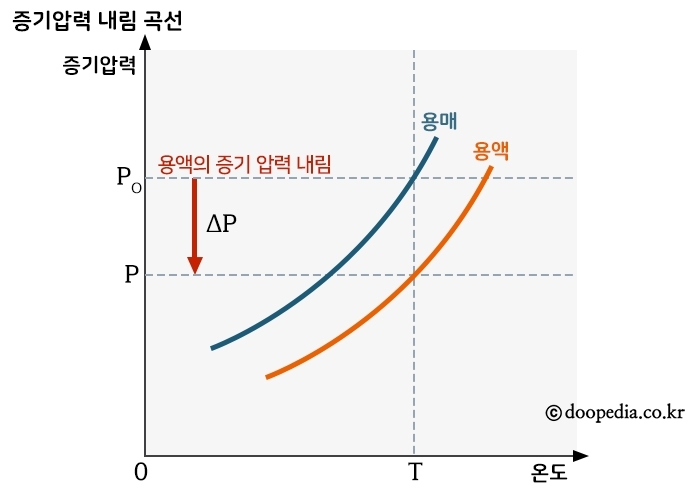
비휘발성, 비전해질인 용질이 녹아 있는 용액의 증기압내림은 용질의 몰분율에 비례한다는 법칙.
1888년 프랑스의 물리화학자 프랑수아 라울(François Marie Raoult)이 실험을 통해 발견한 법칙이다.
비휘발성 물질 용액에서, 용액 속 용매의 증기압은 용매의 몰분율에 비례하며, 또 용액의 증기압내림률은 용질의 몰분율과 같다는 법칙을 말한다.
예를 들면, 휘발성인 에탄올을 물에 녹인 용액의 증기압은 물의 증기압보다 높다. 에탄올은 물보다 끓는점이 낮아 쉽게 증발하기 때문에 물이 증발하는 것을 방해하지 않고 그보다 더 빨리 기화하기 때문이다. 그러나 비휘발성인 설탕을 물에 녹인 용액은 설탕 분자가 물이 증발하는 것을 부분적으로 방해하기 때문에 설탕물의 증기압은 물보다 더 낮아진다. 이런 현상을 '라울의 법칙'이라고 한다.

헨리의 법칙 [ Henry's law ]
일정한 온도에서 용해도는 용매와 평형을 이루고 있는 그 기체의 부분압력에 비례한다.
일정한 온도에서 일정 부피의 액체 용매에 녹는 기체의 질량, 즉 용해도는 용매와 평형을 이루고 있는 그 기체의 부분압력에 비례한다는 법칙이다.
액체상태의 용매에 녹는 기체의 용해도에 관한 법칙으로 이 법칙은 난용성 기체에만 적용되며, 용매에 잘 녹는 기체에 대해서는 적용되지 않는다. 즉, 물에 잘 녹지 않는 기체에 대하여 낮은 압력에서만 적용된다. 이 법칙이 잘 적용되는 기체로는 수소·산소·질소·이산화탄소 등이 있으며, 이 법칙이 잘 적용되지 않는 기체로는 암모니아·염화수소 등이 있다.
이 법칙은 여러 형태로 표시할 수 있으며 그 표시 형태에 따라 헨리 상수도 단위나 수치 등이 다르게 표시된다. 가장 일반적인 방법은 p = k·c 이다. 여기서 p는 atm 단위로 나타낸 기체의 압력, c는 mol/L 단위로 나타낸 기체의 용해도이며 이 경우 헨리의 상수 k의 단위는 L·atm/mol 로 주어진다. 이 형식으로 나타낸 몇 가지 기체의 헨리 상수는 다음과 같다.(온도 298K에서 물에 대한 용해도)
803년 영국의 윌리엄 헨리가 실험적으로 발견하였다. 이상용액에 대한 라울의 법칙이 일반적인 것과 달리 헨리의 법칙은 기체의 압력 및 용해도가 크지 않은 경우에만 근사적으로 성립한다.
압력에 따른 용해도와 관련된 예로는 잠수병을 들 수 있다. 깊은 바다에서 잠수부가 일반적인 공기(질소:산소=4:1)를 흡입하면 높은 압력 때문에 많은 질소가 혈관 속에 녹게 된다. 이 상태에서 급격히 수면 위로 나오는 경우 압력의 감소로 질소의 용해도가 감소하여 질소 기포가 생성되고 이로 인하여 호흡계, 림프계, 근골격계 등에 통증이 유발되는 것이 잠수병이다. 따라서 잠수병을 막기 위해 잠수 호흡용 고압 기체 통에는 질소보다 혈액에 대한 용해도가 매우 작은 헬륨 등을 산소와 혼합하여 사용한다. 또한 심해에서 급격히 수면위로 올라오지 않고 천천히 평형을 유지하면서 올라와도 잠수병을 예방할 수 있다.
이상 용액 [ ideal solution ]
액체 혼합물에서 물질의 몰분율( xA)과 부분 증기압(PA) 사이 관계식에서 라울 법칙, PA = xA PA*이 모든 몰분율에서 성립되는 용액을 말한다. 일반적인 경우 용매 A와 용질 B 모두에게 라울 법칙이 항상 성립하기 어렵다. 그러나 용액을 이루는 각 성분 사이에 작용하는 힘이 성분의 종류에 관계 없이 서로 같을 때 이상 용액을 형성할 것으로 예측할 수 있다. 예를 들어 톨루엔(메틸벤젠)과 벤젠처럼 분자 구조가 비슷한 물질로 이루어진 용액의 경우, 라울 법칙이 모든 몰분율 영역에서 근사적으로 성립하여 이상 용액이라고 할 수 있다.
실제 용액
대부분의 실제 용액은 이상적으로 행동하지 않는다. 만약 아세톤과 물로 이루어진 용액이 있다면 두 분자들이 수소 결합을 할 수 있기 때문에 두 성분 모두 순수한 상태보다는 용액으로부터 탈출하려는 경향이 낮을 것으로 예상할 수 있다. 이처럼 용매가 용질과 특별한 친화력을 가지면 라울 법칙으로부터 음의 편차가 생긴다.
반대로 용질과 용매 사이의 인력이 순수한 액체에서의 인력보다 약한 경우도 가정할 수 있다. 이 경우 용액에 있는 분자들은 쉽게 증발하기 때문에 라울 법칙으로부터 양의 편차가 관찰된다. 극성인 에탄올과 비극성인 헥세인으로 이루어진 용액이 그 예이다.
이상적 묽은 용액 [ideal dilute solution]
대부분의 실제 용액은 라울 법칙을 만족하지 않지만, 용질의 농도가 매우 낮은 묽은 용액의 경우, 용매의 증기 압력은 라울 법칙을 따르고, 용질은 헨리 법칙을 따르는 경우가 있다. 이를 이상적 묽은 용액(ideal dilute solution)이라고 부르며, 증기압과 액체에 녹아 있는 용질의 양을 화학 퍼텐셜을 이용하여 열역학적으로 쉽게 설명할 수 있다.
실제 용액에서 용질 B의 농도가 낮을 경우, 용질 B의 증기압은 그 몰분율에 비례하기는 하지만, 그 비례 상수가 순수한 상태에서의 증기압과 같지 않다. 이를 헨리(William Henry)가 실험적으로 처음 확인하였고, 다음의 헨리 법칙(Henry's Law)으로 표현하였다.
PB = xB KB
여기서 xB는 용질 B의 몰분율이고, KB는 압력의 단위를 가지는 비례 상수이다.
정규 용액 [ 正規溶液 , regular solution ]
이상(理想)용액과의 오차가 주로 혼합열로 인한 (비이상) 용액. 혼합 엔트로피는 이상용액의 경우와 거의 같지만 혼합열은 0이 아니다. 저분자 용액은 정규 용액으로 근사하게 할 수 있는 경우가 많다.
[네이버 지식백과] 라울의 법칙 [Raoult's law] (두산백과)
[네이버 지식백과] 헨리의 법칙 [Henry's law] (두산백과)
[네이버 지식백과] 이상 용액 [ideal solution] (화학백과)
댓글